Aortenaneurysma und Rupturrisikostratifizierung
Als Aortenaneurysma (AA) wird eine krankhafte Erweiterung der Aorta bezeichnet.
Aneurysmen der Aorta werden insbesondere bei Männern im Alter zwischen 65-74 Jahren diagnostiziert und können in allen Abschnitten der Hauptschlagader auftreten, die meisten erscheinen jedoch mit > 85% unterhalb der Abgänge der Nierenarterien, genannt Bauchaortenaneurysmen, oder auch abdominelle Aortenaneurysmen (AAA). Die Prävalenz eines AAA mit einem Durchmesser über 3,0 cm beträgt 4–8 % bei über 65-jährigen Männern und 0,5–1,5 % bei über 65-jährigen Frauen [Härtl 2012]. In Deutschland geht man von 284’000–568’000 über 65-jährigen Männern mit einem AAA > 3,0 cm aus und ≥ 5,0 cm bei mindestens 35’500. Da das Rupturrisiko ab einem Durchmesser von 5,0 cm deutlich ansteigt, ist z.B. in Deutschland von ca. 45’000 über 65-Jährigen mit einem rupturgefährdeten AAA zu rechnen [Härtl 2012]. Zumal Aneurysma weitgehend asymptomatisch verläuft, führt sie bei einer Ruptur in > 80% zum Tod der Betroffenen. Aus diesen Gründen kommt einer individualisierten und zuverlässigen Prognose rupturgefährdeter AAAs eine überragende Bedeutung zu.
Die Indikation zu einer Intervention ist der AAA-Durchmesser von > 5 cm, und/oder rasche Progression des Durchmessers von > 0,5 cm innerhalb von 6 Monaten. Dabei können jedoch auch kleinere Aneurysmen rupturieren und grössere Aneurysmen können durchaus stabil bleiben. Daher ist das derzeitiges diagnostisches Verfahren noch unzureichend. Zudem sind die molekular-biologischen Vorgänge, die zur Aortenruptur führen, noch weitgehend unaufgeklärt.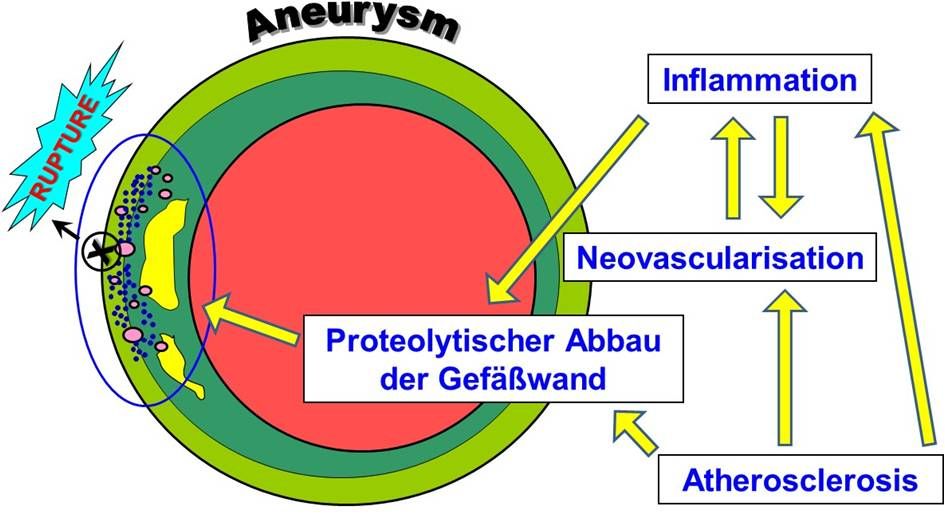
Das Ziel von unserer Forschung ist daher, die pathophysiologischen Prozesse und Mechanismen, die zur Ruptur der Aorta führen, zu ergründen und besser zu verstehen, um eine Basis für neue diagnostische aber auch therapeutischen Ansätze zu schaffen.
Unter anderem versuchen wir, die Aortenwand der rupturierten und nicht-rupturierten Aneurysmen, unter Verwendung von Transcriptom-, Proteom-Analysen und scRNA-sequencing zu vergleichen, mit Fokus insbesondere auf proteolytische Enzyme (MMPs, Cathepsine, ADAMs, ADAMTS) und Strukturproteine der Gefässwand (Kollagen I und III, Elastin, Proteoglykane). Weiterhin stehen im Zentrum unserer Forschung epigenetische Veränderungen und Expression nicht-codierenden RNAs (lncRNA, circRNA) in der erkrankten Aorta.
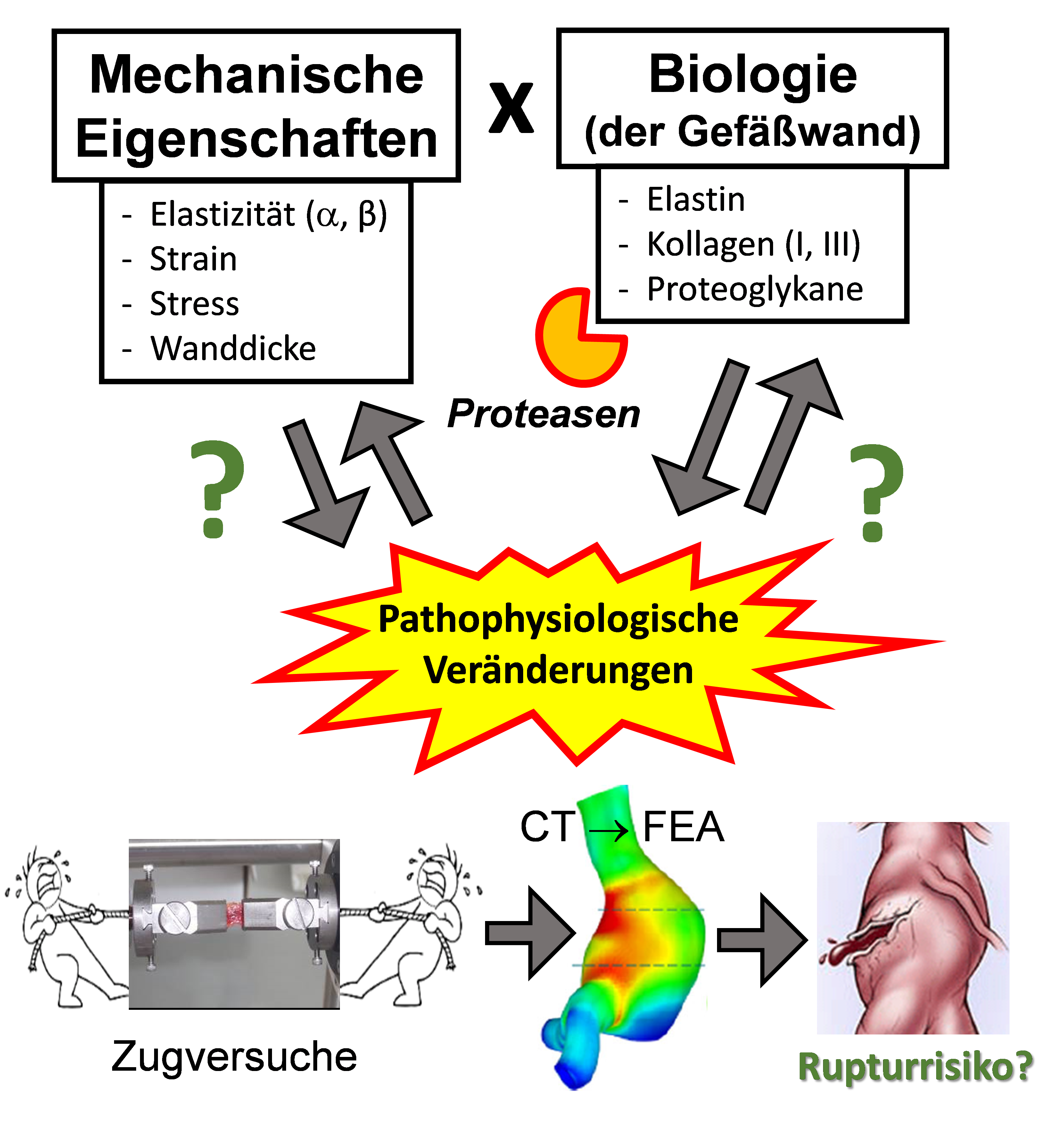
Es ist hervorzuheben, dass die Erweiterung und Ruptur der Aorta den physikalischen Gesetzen der Mechanik unterliegt. Daher sind die Kenntnisse der mechanischen Eigenschaften der Aortenwand bei Aneurysmapatienten und -patientinnen enorm wichtig, um eine Rupturrisikovorhersage treffen zu können. Für die mechanische Stabilität sind insbesondere die Strukturproteine der Gefässwand wie Collagen, Elastin und Proteoglykane verantwortlich.
Folglich haben wir uns auch mit den mechanischen Eigenschaften der erkrankten Aorta gewidmet, indem wir die Aortenproben, in Kooperation mit dem Department of Mechanical Engineering (TU München, Prof. Dr.-Ing. Michael Gee) den Zugversuchen unterzogen haben [Bieler 2017, Reeps, 2014, Reeps 2013, Reeps 2009]. Unsere Ergebnisse zeigten, dass vorzugsweise Kollagen I und III, zusammen mit Dermatan- und Chondroitinsulfat eine wichtige Rolle in der Aortenwandstabilität spielen, dabei ist Kollagen hauptsächlich für die Festigkeit und Steifigkeit der Gefässwand verantwortlich, Proteoglykane für die Elastizität, insbesondere im letzten Stadium, bevor die Gefässwand reisst. Des Weiteren haben unsere Finite Element Analysen (FEA) gezeigt, dass die Form von Aneurysma ebenfalls massgeblich zum Rupturrisiko beitragen kann.
- He Y, Xing J, Wang S, Pelisek J, Jiang H, Xin S, Han Y, Zhang J. Increased m6A mRNA methylation levels are correlated with the progression of human abdominal aortic aneurysm. Epigenetics 2020; submitted.
- Li DY, Busch A, Jin H, Chernogubova E, Pelisek J, Karlsson J, Sennblad B, Liu S, Lao S, Hofmann P, Bäcklund A, Eken SM, Roy J, Eriksson P, Dacken B, Ramanujam D, Dueck A, Engelhardt S, Boon RA, Eckstein HH, Spin JM, Tsao PS, Maegdefessel L. H19 Induces Abdominal Aortic Aneurysm Development and Progression. Circulation. 2018;138(15):1551-1568.
- Kojima Y, Werner N, Ye J, Nanda V, Tsao N, Wang Y, Flores AM, Miller CL, Weissman I, Deng H, Xu B, Dalman RL, Eken SM, Pelisek J, Li Y, Maegdefessel L, Leeper NJ. Proefferocytic Therapy Promotes Transforming Growth Factor-β Signaling and Prevents Aneurysm Formation. 2018;137(7):750-753.
- Klaus V, Tanios-Schmies F, Reeps C, Trenner M, Geisbüsch S, Lohoefer F, Eckstein HH, Pelisek J. Cathepsin B and S are associated with the degraded product of collagen I in abdominal aortic aneurysm VASA. 2018;47(4):285-293.
- Klaus V, Tanios-Schmies F, Reeps C, Trenner M, Matevossian E, Eckstein HH, Pelisek J. Association of MMP levels with collagen degradation in the context of AAA. Eur J Vasc Endovasc Sur. 2017;53:549-558.
- Biehler J, Kehl S, Gee MW, Tanios F, Pelisek J, Maier A, Reeps C, Eckstein HH, Wall WA. Probabilistic Non-Invasive Prediction of Wall Properties of Abdominal Aortic Aneurysms Using Bayesian Regression Biomech Model Mechan. 2017;16(1):45-61.
- Han Y, Tanios F, Reeps C, Zhang J, Schwamborn K, Lutz B, Eckstein HH, Zernecke A, Pelisek J. Histone acetylation and expression of corresponding histone acetyl-transferases in human abdominal aortic aneurysm. Clin Epigenetics. 2016; 8:3.
- Tanios F, Pelisek J, Lutz B, Reutersberg B, Kallmayer M, Matevossian E, Schwamborn K, Hösel V, Eckstein HH, Reeps C. CXCR4: a potential marker for inflammatory activity in abdominal aortic aneurysm wall. Eur J Vasc Endovasc Sur. 2015;50(6):745-753.
- Tanios F, Gee MW, Pelisek J, Kehl S, Biehler J, Haneder S, Grabher-Meier V, Wall WA, Eckstein HH. Reeps C. Interaction of biomechanics with extracellular matrix components in abdominal aortic aneurysm wall. Eur J Vasc Endovasc Surg. 2015;50(2):167-174.
- Lohoefer F, Reeps C, Lipp C, Rudelius M, Haertl M, Eckstein HH, Pelisek J. Quantitative expression and localisation of cysteine proteases in human abdominal aortic aneurysm. Exp Mol Med. 2014;9(6):e90846.
- Reeps C, Kehl S, Tanios F, Biehler J, Pelisek J, Maier A, Wall WA, Eckstein HH, Gee MW. Biomechanics and gene expression in abdominal aortic aneurysm. J Vasc Surg, 2014;60(6):1640-1647.e2.
- Reeps A, Maier A, Pelisek J, Härtl F, Grabher-Meier V, Wall WA, Essler M, Eckstein HH, Gee M. Measuring and Modeling the Patient-Specific Distributions of Material Properties in Abdominal Aortic Aneurysm Wall. Biomech Model Mechanobiol, 2013;12(4):717-733.
- Reeps C, Bundschuh RA, Pelisek J, Herz M, van Marwick S, Schweiger M, Eckstein HH, Nekolla SG, Essler M. (2013) Quantitative assessment of glucose metabolism in the vessel wall of abdominal aortic aneurysms: correlation with histology and role of partial volume correction. Int J Cardiovasc Imaging, 2013;29(2):505-512.
- Härtl F, Reeps C, Wilhelm M, Ockert S, Zimmermann A, Eckstein HH. Offene und endovaskuläre Therapie des abdominalen Aortenaneurysmas: Krankheitsbild – Evidenz – Ergebnisse. Dtsch Med Wochenschr 2012; 137(24): 1303-1308.
- Lipp C, Lohoefer F, Reeps C, Rudelius M, Baumann M, Heemann U, Eckstein HH, Pelisek J. Expression of a disintegrin and metalloprotease family of proteins in human abdominal aortic aneurysms. J Vasc Res. 2012;49(3):198-206.
- Lohoefer F, Reeps C, Lipp C, Rudelius M, Zimmermann A, Eckstein HH, Pelisek J. Histological analysis and localisation of cathepsins in human abdominal aortic aneurysm. Int J Exp Pathol, 2012;93(4):252-258.
- Reeps C, Pelisek J, Seidl S, Schuster T, Zimmermann A, Wendorff H, Kuehnl A, Eckstein HH. Inflammatory infiltrates and neovessels are relevant sources of MMPs in abdominal aortic aneurysm wall. Pathobiology. 2009;76(5):243-252.
- Reeps C, Gee MW, Maier A, Pelisek J, Gurdan M, Wall W, Mariss J, Eckstein HH, Essler M. Glucose Metabolism in the Vessel Wall Correlates With Mechanical Instability and Inflammatory Changes in a Patient With a Growing Aneurysm of the Abdominal Aorta. Circulation – Cardiovasc Imaging. 2009;2(6):507-509.