Die Zuweisung der 36-jährigen Patientin erfolgte wegen unklaren Hautveränderungen, allgemeiner Schwäche und Schmerzen. Die Patientin stammt aus der Karibik. Bisher waren keine chronischen Vorerkrankungen aufgetreten.
Anamnese
Die Patientin berichtete von einem Symptombeginn vor über einem Jahr mit einer Knieschwellung, die im Ausland punktiert und nicht weiter abgeklärt wurde. Im Verlauf kam es zu progredienten, juckenden Hyperpigmentierungen an den Extremitäten, Dekolleté sowie Gesichts- und Kopfhaut mit Haarausfall. Zusätzlich traten Schmerzen in den Händen, Beinen, Becken- und Schultergürtel auf mit einer seit 3 Monaten deutlich progredienten, proximalbetonten Schwäche der Arme und Beine, sodass das Heben der Arme oder Laufen kaum mehr möglich war. Außerdem bestand eine Sicca-Symptomatik. Gemäß eines externen dermatologischen Konsils wurden topische Therapien verordnet, eine klare Diagnose war jedoch nicht aufgeführt. Es bestand ein sehr hoher Leidensdruck aufgrund der langandauernden Beschwerden sowie kosmetisch störenden Hautveränderungen.
Klinische Untersuchung
Klinisch zeigte sich eine afebrile Patientin in reduziertem Allgemeinzustand mit großen konfluierenden hyperpigmentierten Flecken mit erythematösem Rand an den lateralen Oberschenkeln und Oberarmen, oberen Rücken, Dekolleté, Nagelfalz, Gesicht und Kopfhaut mit diffuser Alopezie sowie ein diskretes Erythem streckseitig über den MCP-Gelenken der Hände und im Bereich der Stirn, Wangen und periokulär. Die Gelenksuntersuchung ergab Druckdolenzen und diskrete Schwellungen im Bereich der Handgelenke und PIP-Gelenke beidseits. Die Muskulatur der Ober- und Unterarme sowie Oberschenkel beidseits war druckdolent. Die Musekelkraft der Nackenflexoren und M. glutaeus medius war reduziert, es bestand eine deutlich reduzierte proximal betonte Muskelausdauer von nur 38%. Der internistische Status inklusive Lymphknotenstationen war regelrecht.
Laboruntersuchungen
Die Laboruntersuchung zeigte deutlich erhöhte Muskelwerte (CK 3000 U/l) ohne Erhöhung der Entzündungszeichen (CRP 1,1 mg/l, BSR 19 mm/h). Die immunologische Abklärung ergab deutlich erhöhte antinukleäre Antikörper (ANA) von >1:10240 mit einem AC-4 Muster. Die weitere Differenzierung ergab positive Myositis-spezifische Anti-Mi2- und Anti-SAE1/2-Antikörper. Nur grenzwertig und von fraglicher Relevanz zeigten sich zudem die Anti-SRP- und Anti-NXP2-Antikörper erhöht.
Bildgebung
Mittels ausgedehnten, myositischen Veränderungen der gesamten Stamm- und Extremitätenmuskulatur im Ganzkörper-MRI konnte die Myositis bildgeberisch bestätigt werden. Sonographisch fanden sich eine Arthritis an den Handgelenken beidseits, jedoch keine Synovitis der Fingergelenke. Auf eine Muskelbiopsie wurde aufgrund der eindeutigen Gesamtkonstellation verzichtet und in Zusammenschau der Befunde die Diagnose einer Dermatomyositis gestellt.(➞ siehe Abbildung 1).
Organscreening
Das Organscreening mittels Lungenfunktion inklusive CO-Diffusion und CT-Thorax zeigte keinen Hinweis für eine interstitielle Pneumopathie. Echokardiographisch fanden sich keine Anhaltspunkte für eine pulmonale Hypertonie. Die transthorakale Echokardiographie, Ruhe-EKG und Holter-EKG zeigten einen Normalbefund ohne Hinweise für Reizleitungsstörungen, Ischämie oder Rechtsherzbelastung. Bei anamnestisch rezidivierenden Thoraxbeschwerden erfolgte zusätzlich ein Cardio-MRI, das keinen Hinweis auf Ischämie oder entzündliche Veränderungen zeigte.
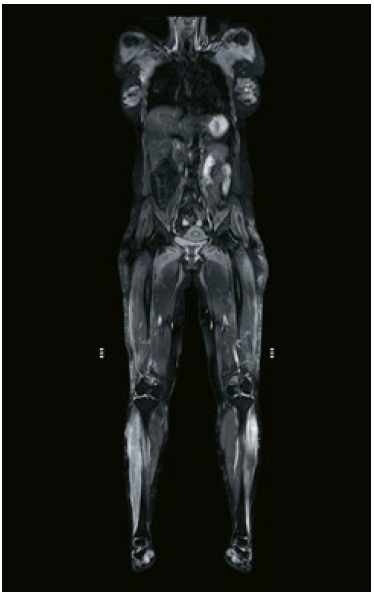
Abbildung 1: Ausgedehnte Signalveränderungen der gesamten Stamm- und Extremitätenmuskulatur, hier gut sichtbar im Extensorenkompartiment der Unterschenkel.
| Gottron Papeln | Rötliche Papeln und Plaques streckseitig über den MCP- und IP- Gelenken (+/- Ulzerationen) |
| Heliotropes Erythem | Gerötete bis violette symmetrische Verfärbung Oberlider (+/- Ödem) |
| Gottron Zeichen | Rötliche Papeln und Plaques streckseitig über den Ellenbogen, Knie und Knöcheln |
| Gesichtserythem | Erythem Wangen und Nasenbrücke inklusive Nasolabialfalte, zum Teil auch Stirn bis Ohren |
| Schal-Zeichen | Erythem Nacken, oberer Rücken, Schultern und laterale Oberarme |
| V-Zeichen | Erythem anteriorer Hals und Dekolleté |
| Poikilodermie | Atrophe Hautveränderungen mit Hyper- und Hypopigmentierungen und Teleangiektasien |
| Holster-Zeichen | Erythem an den proximalen seitlichen Oberschenkeln |
| Finger periungual | Teleangiektasien und Nagelfalzhyperkeratose |
| Mechaniker-Hände | Hyperkeratosen und horizontale Fissuren an den palmaren und lateralen Fingerseiten |
| Kopfhautveränderungen | Poikilodermie mit Schuppung und Pruritus |
| Calcinosis Cutis | Vor allem in späteren Stadien |
Tabelle 1: Hautmanifestationen der Dermatomyostitis (adaptiert nach Qudsiya & Waseem 6,7)
| Anamnese | Detaillierte Systemanamnese (Raynaud-Syndrom, Hautveränderungen, Photosensitivität, Dyspnoe, Medikamente/Noxen) |
| Untersuchung |
|
| Labor |
|
| Auto-Antikörper |
|
| Kapillarmikroskopie | Gefässerweiterungen (Riesenkapillaren), Dysangiogenese mit Büschelkapillaren, ggf. Rarefizierung, Mikroblutungen |
| Bildgebung | MRI Ganzkörper mit T2-gewichteten Sequenzen |
| Optional |
|
| Organscreening |
|
Tabelle 2: Abklärungsempfehlungen bei Verdacht auf Dermatomyositis (adaptiert und ergänzt aus Uptodate 5)
Zusammenhang mit Tumor
Die Prävalenz von Malignomen bei erwachsenen Dermatomyositis-Patienten liegt bei 20 % und ist 5 Jahre ab Diagnosestellung, am deutlichsten aber im ersten Jahr, erhöht. Zum Ausschluss einer paraneoplastischen Genese wurde daher ein CT Hals/Thorax/Abdomen durchgeführt, in der sich nodulär vermehrte KM-Aufnahmen intramammär beidseits zeigten. Bei MR-BIRADS 4 und histopathologisch nicht eindeutiger Differenzierung zwischen Low-Grade Angiosarkom und Angiomatose, ist nach Tumorboardbesprechung zur Abklärung eine offene Biopsie geplant, die aktuell noch ausstehend ist.
Therapie
Therapeutisch wurde eine Stosstherapie mit Prednison 1 mg/kg p.o. gestartet, begleitet von einem PPI-Schutz, einer prophylaktischen antiinfektiösen Therapie mit Trimethoprim/Sulfamethoxazol und einer Osteoporoseprophylaxe mit Calcium und Vitamin D. Aufgrund der Steroidtherapie führten wir eine Knochendichtenmessung durch, die eine normale Knochendichte zeigte. Ein physiotherapeutisch begleitetes Kraft-Training wurde begonnen. Zusätzlich wurde mit intravenösen Immunglobulinen behandelt und eine steroidsparende Therapie mit Methotrexat eingeleitet. Hierunter zeigten sich die Beschwerden und Myositis-Parameter im Labor regredient bei deutlicher Verbesserung des Allgemeinzustandes und der Kraft. Die Hautrötungen klangen rasch ab, aber die Hyperpigmentierungen besserten sich trotz oben genannter Therapie und Sonnenschutz nur langsam.
Take Home Messages
Die Differenzialdiagnose von Dermatomyositis (DM) umfasst entzündliche Myopathien (Polymyositis, nekrotisierende Myositis, Einschlusskörperchenmyositis, Overlap bei anderer rheumatischen Grunderkrankung oder Antisynthetasesyndrom), Muskeldystrophien, metabolische oder infektiöse Myopathien, angeborene Myopathien, Motoneuronerkrankung und Myasthenia gravis. Das Vorhandensein charakteristischer Hautbefunde (siehe Tabelle 1) zusätzlich zur symmetrischen Muskelschwäche sollte dabei helfen, eine DM von diesen Erkrankungen zu unterscheiden. Die Elektromyographie hilft, DM von neuropathischen Ursachen zu unterscheiden. Sofern die Diagnose der DM nicht aufgrund der Klinik, Labor inkl. myositisspezifischer-Antikörper und Bildgebung gestellt werden kann, sollte eine Muskelbiopsie erfolgen (siehe Tabelle 2). Um die Sensitivität zu erhöhen, sollte die Biopsie bei Muskeln mit klinischer Schwäche und im MRI sichtbaren Muskelödem erfolgen und/oder der kontralaterale Muskel zu im EMG als pathologisch erwiesenen Muskel gewählt werden. Muskeln, die in den letzten 6 Wochen mittels ENMG untersucht wurden, sollten nicht biopsiert werden.
Alle Patient*innen sollten auf interstitielle Lungenerkrankungen und Malignität gescreent werden, wobei das Risiko je nach Antikörperprofil unterschiedlich hoch ist. Weitere Untersuchungen auf eine Beteiligung der Speiseröhre oder des Herzens hängen von den vorliegenden Symptomen und Befunden ab.
Hautmanifestationen der Dermatomyositis können je nach Hauttyp unterschiedlich erscheinen. Dunklerer Hauttypen sind in Lehrmaterialien häufig stark unterrepräsentiert, was dazu führen kann, dass bei dunklem Hauttyp die Erkrankung unter- oder fehldiagnostiziert wird.
Eine Dermatomyositis und insbesondere das Ausmass der Hautmanifestation und der Muskelschwäche wirkt sich stark auf die Lebensqualität der Betroffenen aus. Häufig, wie auch bei unserer Patientin, besteht ein sehr hoher Leidensdruck, sodass auf eine gute Beratung und interdisziplinäre Behandlung mit bei Bedarf auch psychologisch/psychiatrischer Behandlung wertgelegt werden sollte.
- Qiang JK, Kim WB, Baibergenova A, Alhusayen R. Risk of Malignancy in Dermatomyositis and Polymyositis: A Systematic Review and Meta-Analysis. Journal of Cutaneous Medicine and Surgery. 2017
- Babool S, Bhai SF, Sanderson C, Salter A, Christopher-Stine L. Racial disparities in skin tone representation of dermatomyositis rashes: a systematic review. Rheumatology (Oxford). 2022
- Goreshi R, Chock M, Foering K, et al. Quality of life in dermatomyositis. J Am Acad Dermatol. 2011
- Hundley JL, Carroll CL, Lang W, et al. Cutaneous symptoms of dermatomyositis significantly impact patients› quality of life. J Am Acad Dermatol. 2006
- Uptodate: Diagnosis and differential diagnosis of dermatomyositis and polymyositis in adults
- Qudsiya Z, Waseem M. Dermatomyositis. [Updated 2023 Aug 7]. In: StatPearls
- Callen JP, Wortmann RL. Dermatomyositis. Clin Dermatol. 2006